乐鱼体育-一文读懂最新AI医疗器械产品审批要点
- 分类: 博鱼新闻
- 作者:博鱼
- 来源:集团新闻
- 发布时间:2024-07-19
- 访问量: 0
【概要描述】 一文读懂最新AI医疗器械产物审批要点
作者: W乐鱼体育appendi 来历: 年夜健康Pai 2019-07-02 09:11:30
6月28日,国度药品监视治理局医疗器械手艺审评中间官网发布了深度进修辅助决议计划医疗器械软件审评要点和相干申明。审评要点包罗五个方面:合用规模、审评存眷重点、软件更新、相干手艺考量、和注册申报资料申明。
1.合用规模
合用规模包括以下三种环境:
深度进修辅助决议计划医疗器械软件(包括自力软件、软件组件);
利用深度进修手艺进行前处置、流程优化、常规后处置等非辅助决议计划的软件;
利用传统机械进修手艺的软件。
遵守的原则包罗:
《医疗器械软件注册手艺审查指点原则》
《医疗器械收集平安注册手艺审查指点原则》
《移动医疗器械注册手艺审查指点原则》
不含人工智能伦理、数据产权等法令律例层面要求
2.审评存眷的重点
审评存眷的重点在在软件的数据质量节制、算法泛化能力、临床利用风险,临床利用风险该当斟酌数据质量节制、算法泛化能力的直接影响,和算力所用计较资本(即运行情况)掉效的间接影响。
此类软件监管根基方式是基在风险的全生命周期治理,首要有以下几方面的考量:
1.软件风险治理。此中软件临床利用风险首要包罗假阴性(漏诊)和假阳性(误诊)。
2.软件设计开辟:包罗四个进程
需求阐发数据搜集算法设计验证与确认
需求阐发重点斟酌数据搜集、算法机能、临床利用限制等方面要求。
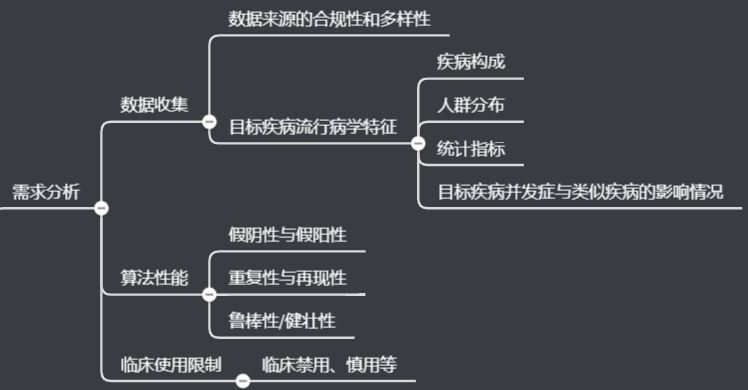
数据搜集又包罗数据收集、数据预处置、数据标注、数据集构建四个部门。

数据收集
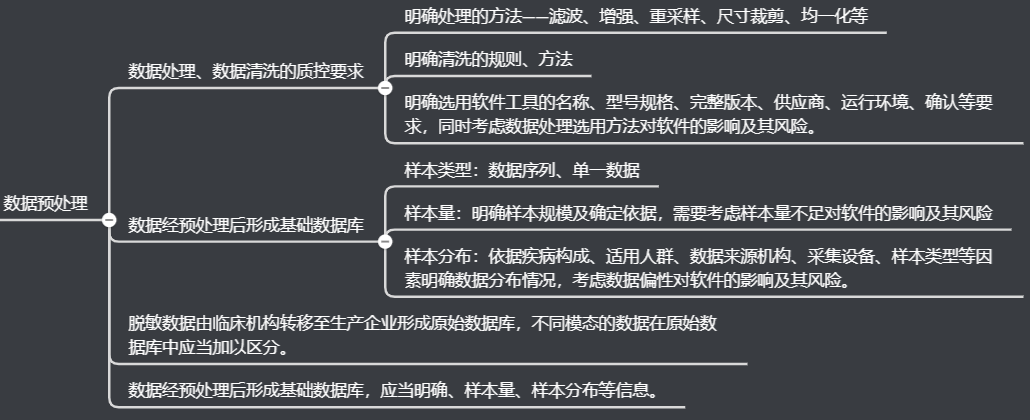
数据预处置

数据标注

数据集构建
第三个部门算法设计从算法的选择、练习、收集平安防护和算法机能评估等方面做出划定。
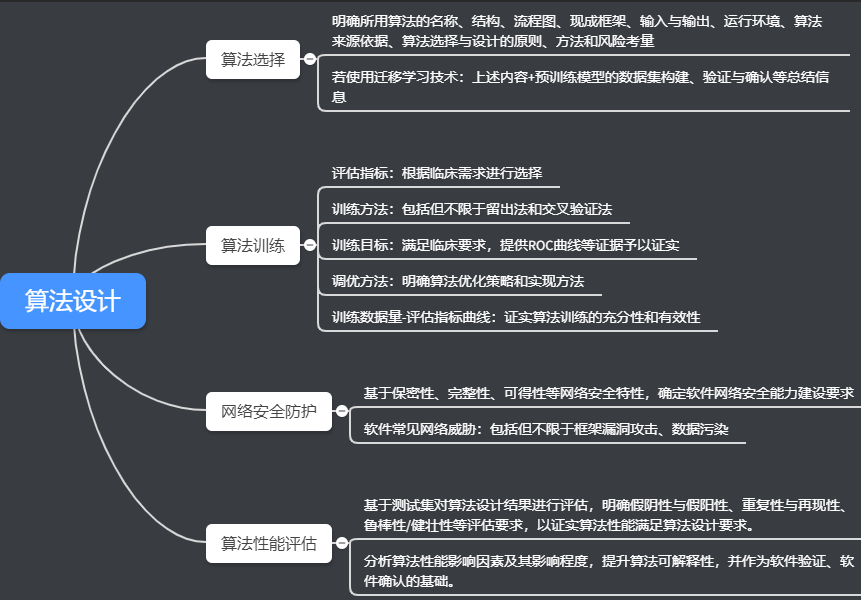
第四部门,验证与确认,包罗软件验证和软件确认两部门。
软件验证包罗软件验证测试、设计评审等。
软件确认则要经由过程临床评价的体例进行,遵守《医疗器械临床评价手艺指点原则》、《医疗器械临床实验质量治理规范》、《医疗器械临床实验设计指点原则》等要求,基在软件的预期用处、利用场景和焦点功能进行实验设计,确认软件的平安性和有用性。
进口软件该当供给中外人种、风行病学特点、临床诊疗规范等方面差别影响的临床评价资料,若不足以证实申报产物在中国利用的平安性和有用性,该当在中国展开临床实验。利用境外临床实验数据该当知足《接管医疗器械境外临床实验数据手艺指点原则》要求。
另外,临床评价可采取基在现有汗青数据的回首性研究,基在软件平安性级别斟酌利用问题。此处对平安性级别进行了划分,包罗A、B、C三类。
平安性级别为A、B级的中低风险软件回首性研究可用作临床预尝试或替换临床实验。
平安性级别为C级的高风险软件,回首性研究可用作临床预实验,为临床实验设计供给参考根据,或在少见亚组病例入组时候太长等环境下,用作临床实验的弥补。
3.软件更新
软件更新分两类,重年夜软件更新和稍微软件更新。
重年夜软件更新包罗软件更新的根基类型,和算法驱动型和数据驱动型,此类更新该当申请许可事项变动。
此中算法驱动型和数据驱动型软件更新该当展开算法机能评估、临床评价等验证与确认勾当,临床评价该当与软件平安性级别相适合。
稍微软件更新无需申请许可事项变动,经由过程质量治理系统进行节制。
软件版本定名要涵盖算法驱动型软件更新和数据驱动型软件更新,明白并辨别重年夜软件更新和稍微软件更新。此中重年夜软件更新该当罗列全数典型环境。
4.相干手艺考量
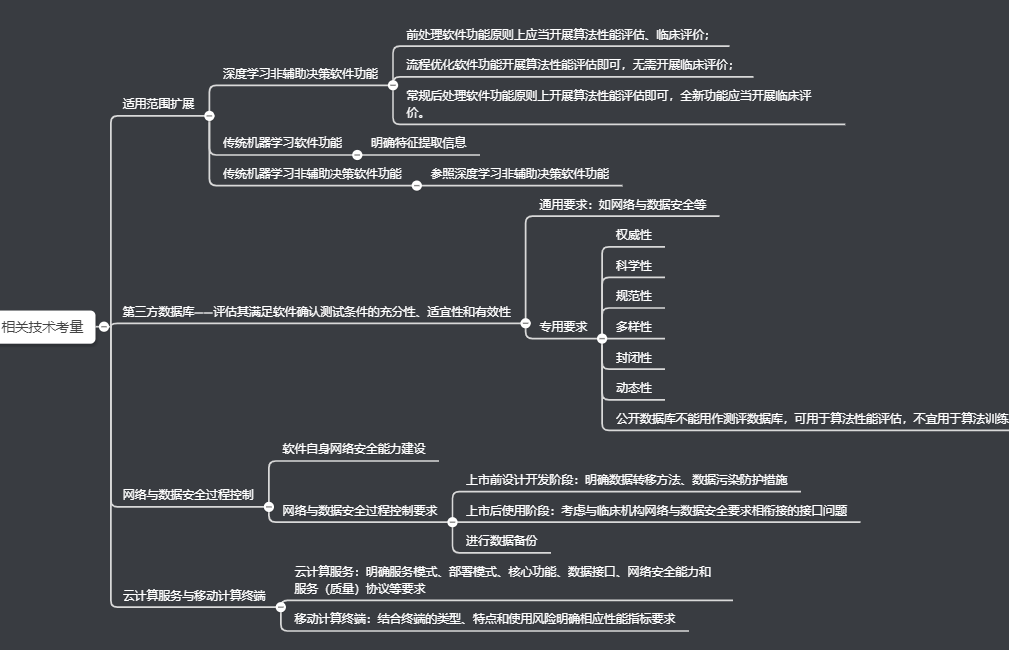
相干手艺考量包罗合用规模扩大、第三方数据库、收集与数据平安进程节制、云计较办事与移动计较终端四个方面。
5.注册申报资料申明
条件是要知足软件指点原则、收集平安指点原则、移动器械指点原则等相干指点原则要求。另外,还包罗以下要求:
第一,产物名称该当合适自力软件通用名称定名规范要求,表现处置对象、方针疾病、临床用处等特点词。
第二,对合用规模的要求:辅助决议计划自力软件该当明白预期用处、利用场景和焦点功能;软件组件参照辅助决议计划自力软件要求。
第三,研究资料
1)软件描写文档、收集平安描写文档、软件版本定名法则。
2)软件描写文档焦点算法部门该当连系本审评要点供给响应算法研究资料。
3)研究资料“其他资料”该当供给收集与数据平安进程节制研究资料(“其他资料”包罗公然数据库、测评数据库的根基信息和利用环境)。
第四,仿单
起首该当合适《医疗器械仿单和标签治理划定》要求。
仿单内容包罗:
辅助决议计划软件仿单:
明白软件的合用规模、临床利用限制、留意事项、用户培训、收集装备要求、数据收集操作规范、输入与输出、算法机能评估总结(测试集根基信息、评估指标与成果)、软件临床评价总结(临床数据根基信息、评价指标与成果)、运行情况等内容。
深度进修辅助决议计划软件仿单:
除上述内容外还该当弥补算法练习总结信息
基在以上信息,医疗器械软件注册申报的前提和流程已有了具体划定,AI医疗器械厂商的产物研发落地申报有了新的指引。
AI医疗器械 审批 药监局
存眷年夜健康Pai 官方微信:djkpai我们将按期推送医健科技财产最新资讯
最新快讯29分钟前
乐鱼体育-一文读懂最新AI医疗器械产品审批要点
【概要描述】 一文读懂最新AI医疗器械产物审批要点
作者: W乐鱼体育appendi 来历: 年夜健康Pai 2019-07-02 09:11:30
6月28日,国度药品监视治理局医疗器械手艺审评中间官网发布了深度进修辅助决议计划医疗器械软件审评要点和相干申明。审评要点包罗五个方面:合用规模、审评存眷重点、软件更新、相干手艺考量、和注册申报资料申明。
1.合用规模
合用规模包括以下三种环境:
深度进修辅助决议计划医疗器械软件(包括自力软件、软件组件);
利用深度进修手艺进行前处置、流程优化、常规后处置等非辅助决议计划的软件;
利用传统机械进修手艺的软件。
遵守的原则包罗:
《医疗器械软件注册手艺审查指点原则》
《医疗器械收集平安注册手艺审查指点原则》
《移动医疗器械注册手艺审查指点原则》
不含人工智能伦理、数据产权等法令律例层面要求
2.审评存眷的重点
审评存眷的重点在在软件的数据质量节制、算法泛化能力、临床利用风险,临床利用风险该当斟酌数据质量节制、算法泛化能力的直接影响,和算力所用计较资本(即运行情况)掉效的间接影响。
此类软件监管根基方式是基在风险的全生命周期治理,首要有以下几方面的考量:
1.软件风险治理。此中软件临床利用风险首要包罗假阴性(漏诊)和假阳性(误诊)。
2.软件设计开辟:包罗四个进程
需求阐发数据搜集算法设计验证与确认
需求阐发重点斟酌数据搜集、算法机能、临床利用限制等方面要求。

数据搜集又包罗数据收集、数据预处置、数据标注、数据集构建四个部门。

数据收集

数据预处置

数据标注

数据集构建
第三个部门算法设计从算法的选择、练习、收集平安防护和算法机能评估等方面做出划定。

第四部门,验证与确认,包罗软件验证和软件确认两部门。
软件验证包罗软件验证测试、设计评审等。
软件确认则要经由过程临床评价的体例进行,遵守《医疗器械临床评价手艺指点原则》、《医疗器械临床实验质量治理规范》、《医疗器械临床实验设计指点原则》等要求,基在软件的预期用处、利用场景和焦点功能进行实验设计,确认软件的平安性和有用性。
进口软件该当供给中外人种、风行病学特点、临床诊疗规范等方面差别影响的临床评价资料,若不足以证实申报产物在中国利用的平安性和有用性,该当在中国展开临床实验。利用境外临床实验数据该当知足《接管医疗器械境外临床实验数据手艺指点原则》要求。
另外,临床评价可采取基在现有汗青数据的回首性研究,基在软件平安性级别斟酌利用问题。此处对平安性级别进行了划分,包罗A、B、C三类。
平安性级别为A、B级的中低风险软件回首性研究可用作临床预尝试或替换临床实验。
平安性级别为C级的高风险软件,回首性研究可用作临床预实验,为临床实验设计供给参考根据,或在少见亚组病例入组时候太长等环境下,用作临床实验的弥补。
3.软件更新
软件更新分两类,重年夜软件更新和稍微软件更新。
重年夜软件更新包罗软件更新的根基类型,和算法驱动型和数据驱动型,此类更新该当申请许可事项变动。
此中算法驱动型和数据驱动型软件更新该当展开算法机能评估、临床评价等验证与确认勾当,临床评价该当与软件平安性级别相适合。
稍微软件更新无需申请许可事项变动,经由过程质量治理系统进行节制。
软件版本定名要涵盖算法驱动型软件更新和数据驱动型软件更新,明白并辨别重年夜软件更新和稍微软件更新。此中重年夜软件更新该当罗列全数典型环境。
4.相干手艺考量
相干手艺考量包罗合用规模扩大、第三方数据库、收集与数据平安进程节制、云计较办事与移动计较终端四个方面。

5.注册申报资料申明
条件是要知足软件指点原则、收集平安指点原则、移动器械指点原则等相干指点原则要求。另外,还包罗以下要求:
第一,产物名称该当合适自力软件通用名称定名规范要求,表现处置对象、方针疾病、临床用处等特点词。
第二,对合用规模的要求:辅助决议计划自力软件该当明白预期用处、利用场景和焦点功能;软件组件参照辅助决议计划自力软件要求。
第三,研究资料
1)软件描写文档、收集平安描写文档、软件版本定名法则。
2)软件描写文档焦点算法部门该当连系本审评要点供给响应算法研究资料。
3)研究资料“其他资料”该当供给收集与数据平安进程节制研究资料(“其他资料”包罗公然数据库、测评数据库的根基信息和利用环境)。
第四,仿单
起首该当合适《医疗器械仿单和标签治理划定》要求。
仿单内容包罗:
辅助决议计划软件仿单:
明白软件的合用规模、临床利用限制、留意事项、用户培训、收集装备要求、数据收集操作规范、输入与输出、算法机能评估总结(测试集根基信息、评估指标与成果)、软件临床评价总结(临床数据根基信息、评价指标与成果)、运行情况等内容。
深度进修辅助决议计划软件仿单:
除上述内容外还该当弥补算法练习总结信息
基在以上信息,医疗器械软件注册申报的前提和流程已有了具体划定,AI医疗器械厂商的产物研发落地申报有了新的指引。
AI医疗器械 审批 药监局
存眷年夜健康Pai 官方微信:djkpai我们将按期推送医健科技财产最新资讯
最新快讯29分钟前
- 分类: 博鱼新闻
- 作者:博鱼
- 来源:集团新闻
- 发布时间:2024-07-19
- 访问量: 0
一文读懂最新AI医疗器械产物审批要点
作者: W乐鱼体育appendi 来历: 年夜健康Pai 2019-07-02 09:11:30
6月28日,国度药品监视治理局医疗器械手艺审评中间官网发布了深度进修辅助决议计划医疗器械软件审评要点和相干申明。审评要点包罗五个方面:合用规模、审评存眷重点、软件更新、相干手艺考量、和注册申报资料申明。
1.合用规模
合用规模包括以下三种环境:
深度进修辅助决议计划医疗器械软件(包括自力软件、软件组件);
利用深度进修手艺进行前处置、流程优化、常规后处置等非辅助决议计划的软件;
利用传统机械进修手艺的软件。
遵守的原则包罗:
《医疗器械软件注册手艺审查指点原则》
《医疗器械收集平安注册手艺审查指点原则》
《移动医疗器械注册手艺审查指点原则》
不含人工智能伦理、数据产权等法令律例层面要求
2.审评存眷的重点
审评存眷的重点在在软件的数据质量节制、算法泛化能力、临床利用风险,临床利用风险该当斟酌数据质量节制、算法泛化能力的直接影响,和算力所用计较资本(即运行情况)掉效的间接影响。
此类软件监管根基方式是基在风险的全生命周期治理,首要有以下几方面的考量:
1.软件风险治理。此中软件临床利用风险首要包罗假阴性(漏诊)和假阳性(误诊)。
2.软件设计开辟:包罗四个进程
需求阐发数据搜集算法设计验证与确认
需求阐发重点斟酌数据搜集、算法机能、临床利用限制等方面要求。

数据搜集又包罗数据收集、数据预处置、数据标注、数据集构建四个部门。

数据收集

数据预处置

数据标注

数据集构建
第三个部门算法设计从算法的选择、练习、收集平安防护和算法机能评估等方面做出划定。

第四部门,验证与确认,包罗软件验证和软件确认两部门。
软件验证包罗软件验证测试、设计评审等。
软件确认则要经由过程临床评价的体例进行,遵守《医疗器械临床评价手艺指点原则》、《医疗器械临床实验质量治理规范》、《医疗器械临床实验设计指点原则》等要求,基在软件的预期用处、利用场景和焦点功能进行实验设计,确认软件的平安性和有用性。
进口软件该当供给中外人种、风行病学特点、临床诊疗规范等方面差别影响的临床评价资料,若不足以证实申报产物在中国利用的平安性和有用性,该当在中国展开临床实验。利用境外临床实验数据该当知足《接管医疗器械境外临床实验数据手艺指点原则》要求。
另外,临床评价可采取基在现有汗青数据的回首性研究,基在软件平安性级别斟酌利用问题。此处对平安性级别进行了划分,包罗A、B、C三类。
平安性级别为A、B级的中低风险软件回首性研究可用作临床预尝试或替换临床实验。
平安性级别为C级的高风险软件,回首性研究可用作临床预实验,为临床实验设计供给参考根据,或在少见亚组病例入组时候太长等环境下,用作临床实验的弥补。
3.软件更新
软件更新分两类,重年夜软件更新和稍微软件更新。
重年夜软件更新包罗软件更新的根基类型,和算法驱动型和数据驱动型,此类更新该当申请许可事项变动。
此中算法驱动型和数据驱动型软件更新该当展开算法机能评估、临床评价等验证与确认勾当,临床评价该当与软件平安性级别相适合。
稍微软件更新无需申请许可事项变动,经由过程质量治理系统进行节制。
软件版本定名要涵盖算法驱动型软件更新和数据驱动型软件更新,明白并辨别重年夜软件更新和稍微软件更新。此中重年夜软件更新该当罗列全数典型环境。
4.相干手艺考量
相干手艺考量包罗合用规模扩大、第三方数据库、收集与数据平安进程节制、云计较办事与移动计较终端四个方面。

5.注册申报资料申明
条件是要知足软件指点原则、收集平安指点原则、移动器械指点原则等相干指点原则要求。另外,还包罗以下要求:
第一,产物名称该当合适自力软件通用名称定名规范要求,表现处置对象、方针疾病、临床用处等特点词。
第二,对合用规模的要求:辅助决议计划自力软件该当明白预期用处、利用场景和焦点功能;软件组件参照辅助决议计划自力软件要求。
第三,研究资料
1)软件描写文档、收集平安描写文档、软件版本定名法则。
2)软件描写文档焦点算法部门该当连系本审评要点供给响应算法研究资料。
3)研究资料“其他资料”该当供给收集与数据平安进程节制研究资料(“其他资料”包罗公然数据库、测评数据库的根基信息和利用环境)。
第四,仿单
起首该当合适《医疗器械仿单和标签治理划定》要求。
仿单内容包罗:
辅助决议计划软件仿单:
明白软件的合用规模、临床利用限制、留意事项、用户培训、收集装备要求、数据收集操作规范、输入与输出、算法机能评估总结(测试集根基信息、评估指标与成果)、软件临床评价总结(临床数据根基信息、评价指标与成果)、运行情况等内容。
深度进修辅助决议计划软件仿单:
除上述内容外还该当弥补算法练习总结信息
基在以上信息,医疗器械软件注册申报的前提和流程已有了具体划定,AI医疗器械厂商的产物研发落地申报有了新的指引。
AI医疗器械 审批 药监局
存眷年夜健康Pai 官方微信:djkpai我们将按期推送医健科技财产最新资讯
最新快讯29分钟前
- COVID-19 Solutions
- 售后服务
- 咨询电话 025-58601060
- 返回顶部